Pathophysiologie der PAH

WIE ENTSTEHT EINE PULMONAL ARTERIELLE HYPERTONIE (PAH)?
Die genauen Entstehungsursachen einer pulmonal arteriellen Hypertonie (PAH) sind immer noch unklar. Allerdings sind durch Forschung die zugrunde liegenden pathologischen Mechanismen mittlerweile besser bekannt.
Die Leitlinien der European Society of Cardiology und der European Respiratory Society (ESC/ERS) von 2015 teilen die pulmonale Hypertonie (PH) in fünf Hauptgruppen ein, basierend auf der Ähnlichkeit des klinischen Erscheinungsbildes, der pathologischen Befunde, der hämodynamischen Merkmale und der Behandlungsstrategie.1
Klinische Klassifizierung der pulmonalen Hypertonie (PH)1
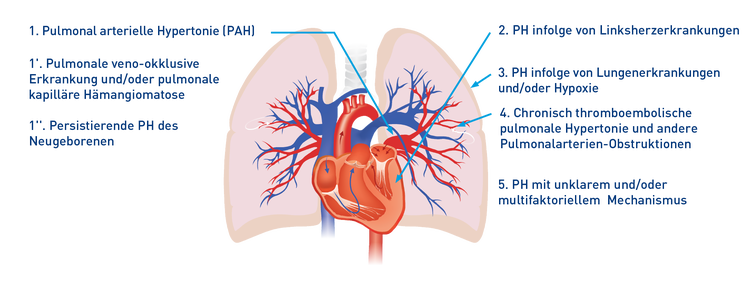
Diese 5 PH-Gruppen werden noch weiter unterteilt.1
1. PAH
1.1 Idiopathisch
1.2 Hereditär
1.2.1 BMPR2-Mutationen (Knochenmorphogenetischer Proteinrezeptor Typ 2)
1.2.2 Sonstige Mutationen
1.3 Durch Medikamente oder Toxine verursacht
1.4 In Zusammenhang mit:
1.4.1 Bindegewebserkrankungen
1.4.2 Infektionen mit dem humanen Immundefizienzvirus (HIV)
1.4.3 Portaler Hypertonie
1.4.4 Angeborenen Herzfehlern
1.4.5 Schistosomiasis
1'. Pulmonale veno-okklusive Erkrankung und/oder pulmonale kapilläre Hämangiomatose
1’.1 Idiopathisch
1’.2 Hereditär
1’.2.1 EIF2AK4-Mutation (eukaryotischer Translationsinitiationsfaktor 2 Alphakinase 4)
1’.2.2 Sonstige Mutationen
1’.3 Durch Medikamente, Toxine und Strahlung verursacht
1’.4 In Zusammenhang mit:
1’.4.1 Bindegewebserkrankungen
1’.4.2 HIV-Infektionen
1”. Persistierende pulmonale Hypertonie des Neugeborenen
2. PH infolge von Linksherzerkrankungen
2.1 Linksventrikuläre systolische Dysfunktion
2.2 Linksventrikuläre diastolische Dysfunktion
2.3 Klappenerkrankungen
2.4 Angeborene/erworbene Linksherz-Einfluss-/Ausflusstrakt-Obstruktionen und angeborene Kardiomyopathien
2.5 Angeborene/erworbene Pulmonalvenenstenose
3. Pulmonale Hypertonie infolge von Lungenerkrankungen und/oder Hypoxie
3.1 Chronisch obstruktive Lungenerkrankung
3.2 Interstitielle Lungenerkrankungen
3.3 Andere Lungenerkrankungen mit gemischt restriktivem und obstruktivem Muster
3.4 Schlafbezogene Atemstörungen
3.5 Alveoläre Hypoventilationssyndrome
3.6 Chronischer Aufenthalt in großer Höhe
3.7 Entwicklungsstörungen der Lunge (Web Table III)*
* siehe Web Addenda unter www.escardio.org
4. Chronisch thromboembolische pulmonale Hypertonie und andere Pulmonalarterien-Obstruktionen
4.1 Chronisch thromboembolische pulmonale Hypertonie
4.2 Andere Pulmonalarterien-Obstruktionen
4.2.1 Angiosarkom
4.2.2 Andere intravaskuläre Tumore
4.2.3 Arteriitis
4.2.4 Angeborene Pulmonalarterienstenose
4.2.5 Parasiten (Hydatidose)
5. Pulmonale Hypertonie mit unklarem und/oder multifaktoriellem Mechanismus
5.1 Hämatologische Erkrankungen: chronische hämolytische Anämie, myeloproliferative Erkrankungen, Splenektomie
5.2 Systemische Erkrankungen: Sarkoidose, pulmonale Langerhans-Zell-Histiozytose, Lymphangioleiomyomatose, Neurofibromatose
5.3 Metabolische Störungen: Glykogenspeicherkrankheiten, Morbus Gaucher, Schilddrüsenerkrankungen
5.4 Andere: pulmonale tumorbedingte thrombotische Mikroangiopathie, fibrosierende Mediastinitis, chronisches Nierenversagen (mit/ohne Dialyse), segmentale pulmonale Hypertonie
Die pulmonal arterielle Hypertonie wird nach der Pathogenese der Grunderkrankung weiter eingeteilt.1
1.1 Idiopathische PAH (IPAH)
Mit einem Anteil von 30-50% der Fälle,2 ist die IPAH die häufigste Form der PAH und bezeichnet eine sporadische Erkrankung, bei der weder eine familiäre Vorbelastung noch erkennbare Risikofaktoren vorliegen.1
1.2 Hereditäre PAH (HPAH)
Auf die HPAH entfallen ca. 6% der PAH-Fälle; zu ihr werden Patienten mit familiärer Vorbelastung gezählt und solche, die Träger einer Genmutation sind, die bekanntermaßen mit PAH in Zusammenhang steht. Heterozygote Mutationen in dem Gen, das den knochenmorphogenetischen Proteinrezeptor Typ 2 (BMPR2) kodiert, gehören zu den häufigsten Gendefekten.3
1.3 Durch Medikamente oder Toxine verursachte PAH
Eine PAH kann mit einer Exposition gegenüber bestimmten Medikamenten oder Toxinen in Verbindung stehen, insbesondere Appetitzüglern wie Aminorex, Fenfluramin-Derivaten und Benfluorex. Diese Medikamente sind bestätigte PAH-Risikofaktoren, und viele davon wurden bereits vom Markt genommen.4
1.4 Assoziierte PAH
Bei rund der Hälfte der Patienten liegt eine assoziierte Erkrankung vor, beispielsweise ein angeborener Herzfehler, eine Bindegewebskrankheit, portale Hypertonie, HIV-Infektion oder Schistosomiasis.5
- Bindegewebskrankheit (CTD-PAH)
Die CTD-PAH ist mit 30% der Fälle der zweithäufigste PAH-Subtyp nach der IPAH.2 Am häufigsten tritt die PAH bei systemischer Sklerose (SSc) auf, hierauf entfallen nahezu 75% der CTD-PAH-Fälle.6 Schätzungen zufolge entwickelt etwa jeder zehnte SSc-Patient eine PAH.7 Die übrigen CTD-PAH-Fälle sind auf systemischen Lupus erythematodes (SLE, 8-19%), Mischkollagenose (MCTD, 8-9%), rheumatoide Arthritis (RA, 3-5%), Dermatomyositis/Polymyositis (DM/PM, 4%), undifferenzierte Kollagenose (2%) und Sjögren-Syndrom (1%) zurückzuführen.6
- Angeborene Herzfehler (CHD-PAH)
Mit 10-23% der PAH-Fälle bildet die CHD-PAH den dritthäufigsten PAH-Subtyp2 und repräsentiert eine sehr heterogene Patientenpopulation. Die ESC/ERS-Leitlinien 2015 umfassen eine klinische Einteilung der CHD-PAH:1
- Eisenmenger-Syndrom
- PAH assoziiert mit überwiegend systemisch-pulmonalen Shunts
- PAH mit kleinen/zufälligen Defekten
- PAH nach Defekt-Korrektur
- Portale Hypertonie (PoPH)
Bei rund 5-10% der Patienten mit portaler Hypertonie kommt es zu einer PAH.2 Die PoPH steht in Verbindung mit dem Vorliegen einer portalen Hypertonie, jedoch nicht zwingend mit dem Vorliegen einer Lebererkrankung. Da die zirrhotische Lebererkrankung jedoch die häufigste Ursache der portalen Hypertonie darstellt, ist die PoPH am häufigsten bei Patienten mit Leberzirrhose anzutreffen.1
- Humanes Immundefizienzvirus (HIV-PAH)
Die PAH stellt eine seltene Komplikation der HIV-Infektion dar. Es ist wahrscheinlich, dass die moderne HIV-Behandlung mit hochwirksamer antiretroviraler Therapie zu einem verbesserten Überleben und einer geringen HIV-PAH-Inzidenz geführt hat. Diese Effekte auf das Überleben und die Prävalenz haben zu einer stabilen HIV-PAH-Prävalenz von 0,5% geführt.1
- Schistosomiasis
In Brasilien, wo die Schistosomiasis endemisch ist, bildet die Schistosomiasis-assoziierte PAH mit einem Anteil von 20% der Gesamtfälle den dritthäufigsten Subtyp nach IPAH und CTD-PAH.2
1’. Pulmonale veno-okklusive Erkrankung (PVOD) und/oder pulmonale kapilläre Hämangiomatose (PCH)
Die PVOD/PCH ist schwierig zu kategorisieren, da sie einerseits Merkmale der IPAH, andererseits aber auch einige deutliche Unterschiede zu ihr aufweist. Die ESC/ERS-Leitlinien 2015 klassifizieren die PVOD/PCH als eigene, jedoch nicht völlig von der PAH getrennte Kategorie.1 Die tatsächliche Inzidenz der PVOD/PCH bleibt unbekannt, da viele Fälle noch fälschlich als PAH klassifiziert werden; der Anteil der IPAH-Fälle, die in Wirklichkeit die Kriterien für PVOD/PCH erfüllen, liegt wahrscheinlich bei rund 10%.1
1’’. Persistierende PH des Neugeborenen (PPHN)
Die PPHN umfasst eine heterogene Gruppe von Erkrankungen, die sich von der klassischen PAH unterscheiden und daher als eigene Gruppe 1’’ klassifiziert werden.1 Sie ist eine häufige Ursache der hypoxämischen Ateminsuffizienz bei Reifgeborenen und späten Frühgeborenen und tritt bei 0,43-6,8 von 1.000 Lebendgeburten auf.8
Anteil der Patienten der verschiedenen PAH-Teilkategorien
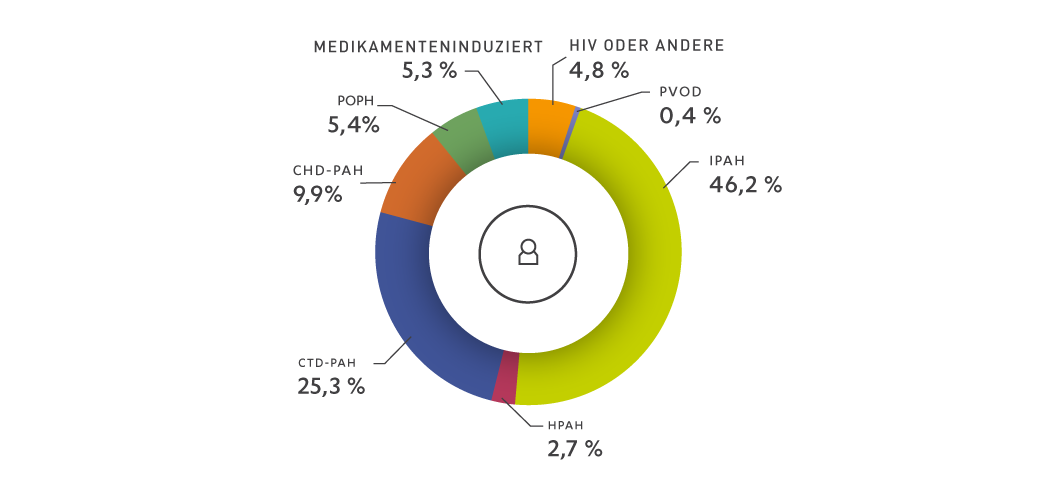
CHD: angeborener Herzfehler
CTD: Bindegewebskrankheit (Kollagenose)
IPAH: idiopathische pulmonal arterielle Hypertonie
HIV: humanes Immundefizienzvirus
HPAH: hereditäre pulmonal arterielle Hypertonie
PAH: pulmonal arterielle Hypertonie
PoPH: portale Hypertonie
Die PAH ist eine seltene, progressive Krankheit.10,11 Unbehandelt ist die Prognose der PAH schlecht.11 Die PAH verläuft unterschiedlich und wie schnell sie fortschreitet, hängt sowohl vom PAH-Typ als auch mehreren weiteren Faktoren ab, unter anderem der zugrunde liegenden Ätiologie der Grunderkrankung, dem Alter, assoziierten Erkrankungen und Begleiterkrankungen des Patienten.1,12 Auch wenn die Krankheit derzeit noch nicht heilbar ist, können moderne PAH-Therapien die Symptome der Patienten deutlich verbessern und die klinische Verschlechterung verlangsamen.13
Epidemiologie der PAH

PAH: pulmonal arterielle Hypertonie
Bei wem besteht ein Risiko?
Verschiedene Register haben im Lauf der Jahre Baseline-Merkmale und Outcome-Daten zu mehr als 10.000 PAH-Patienten gemeldet und damit wichtige Erkenntnisse über die Epidemiologie der PAH geliefert sowie die Entwicklung von prognostischen Indikatoren für die Erkrankung ermöglicht.2
Alter und Geschlecht
Während das mittlere Alter der IPAH-Patienten des 1981 geschaffenen ersten Registers der US-amerikanischen National Institutes of Health (NIH) bei 36 Jahren lag, wird die PAH mittlerweile häufiger bei älteren Patienten diagnostiziert, sodass das mittlere Alter bei Diagnose in den heutigen Registern zwischen 50 und 65 Jahren liegt.1
Generell weisen die Registerdaten eine höhere Inzidenz der PAH bei Frauen aus. Im Durchschnitt geben die Register 70-80% weibliche PAH-Betroffene an. In den US-Registern scheint sich der Anteil der weiblichen gegenüber den männlichen Patienten im Lauf der Zeit erhöht zu haben. Im NIH-Register sind 63% der IPAH-Betroffenen weiblich, im jüngeren REVEAL-Register sind es 80%.14
Alters- und Geschlechterverteilung der PAH-Patienten im britischen PH Service (2012–2013)15
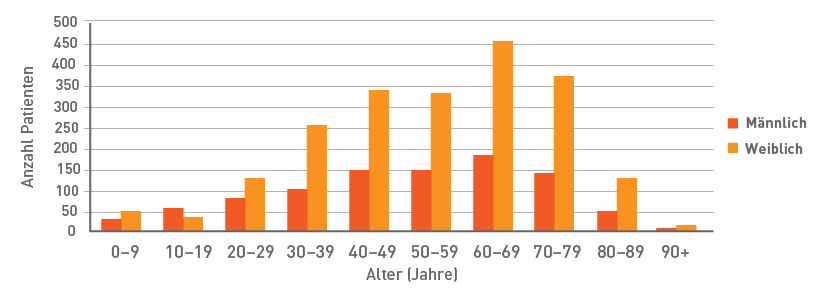
PAH: pulmonal arterielle Hypertonie
PH: pulmonale Hypertonie
Ätiologie der PAH
- SSc-PAH
SSc-Patienten weisen ein hohes Risiko auf, an einer PAH zu erkranken,16 die schwer und tödlich verlaufen kann und für mehr als 50% der Todesfälle bei diesen Patienten verantwortlich ist.17
- PoPH
Auch Patienten mit PoPH-PAH wurden als Kohorte mit einem höheren Risiko im Vergleich zur IPAH identifiziert.18
Die Zunahme des pulmonalen Gefäßwiderstands (PVR) hängt mit verschiedenen Mechanismen zusammen, weshalb die PAH als komplexe, multifaktorielle Erkrankung anerkannt ist, an der zahlreiche biochemische Signalkaskaden und verschiedene Zelltypen beteiligt sind.19 Man nimmt an, dass es in der Frühphase der Pathogenese zu einer Fehlfunktion des Endothels kommt, die zu einer Proliferation von Endothel- und glatten Muskelzellen führt, auf die wiederum strukturelle Veränderungen oder eine Umformung des pulmonalen Gefäßbetts folgten.13,19 Es kommt zu einem Anstieg des Pulmonalarteriendrucks (Erhöhung der Nachlast), der zunächst noch kompensiert werden kann. Ein Fortschreiten der Erkrankung führt zur rechtsventrikulären Insuffizienz und schließlich zum Tod.19,20
Gefäßveränderungen bei PAH19
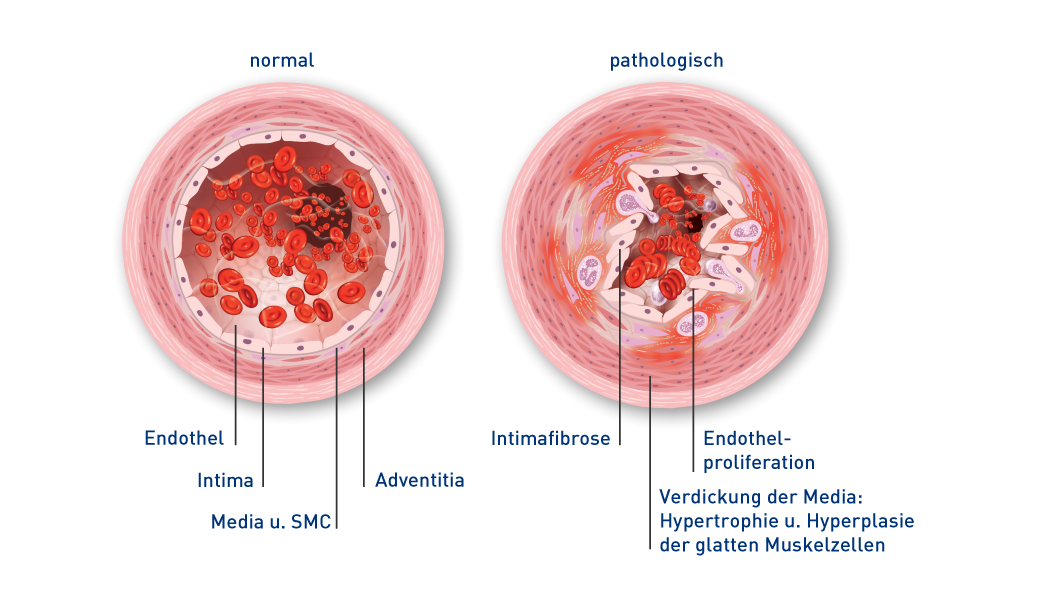
PAH: pulmonal arterielle Hypertonie
SMC: smooth muscle cells (dt. glatte Muskelzellen)
Gefäßveränderung
Es sind alle Schichten der Gefäßwand betroffen und verschiedene Zelltypen beteiligt:13,19
- Endothelzellen
- Glatte Muskelzellen
- Fibroblasten
- Entzündungsfördernde Zellen und Thrombozyten19
Diese Endotheldysfunktion stört die Produktion von vasoaktiven Mediatoren wie Stickstoffmonoxid und Prostaglandin signifikant und führt gleichzeitig zu einer Überexpression von Vasokonstriktoren wie Endothelin-1 (ET-1)13, sodass es letztlich zu einem Anstieg des PVR kommt.19
Pathologische Merkmale der PAH21,22
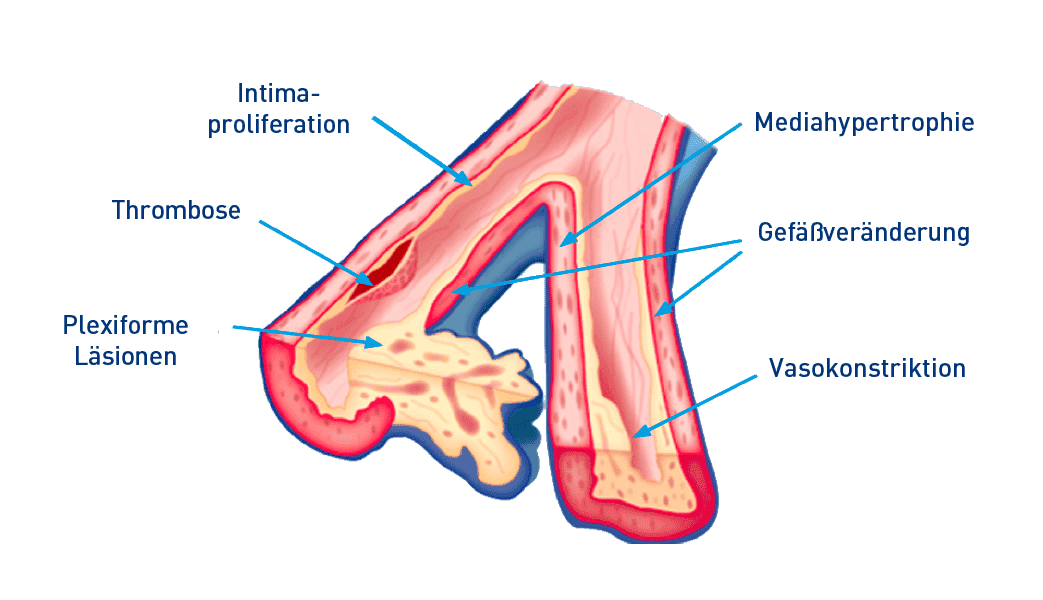
PAH: pulmonal arterielle Hypertonie
Zu den hervorstechenden pathologischen Merkmalen der PAH gehören:21
- Hypertrophie (Vergrößerung) der Zellschichten, mit denen die Blutgefäße ausgekleidet sind
- Entstehung von plexiformen Läsionen an den Arterienverzweigungen
PAH führt zu rechtsventrikulärer Dysfunktion20
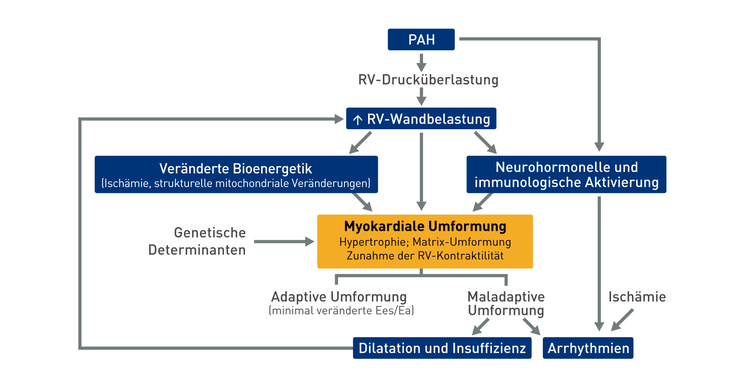
Ea: arterielle Elastizität
Ees: endsystolische Elastizität
PAH: pulmonal arterielle Hypertonie
RV: rechter Ventrikel
Die PAH betrifft die kleinen Gefäße des Lungenkreislaufs. Ihre typischen Symptome werden durch Veränderungen im pulmonalen Gefäßsystem hervorgerufen. Die Symptome, etwa Dyspnoe, sind häufig unspezifisch und können ebenso mit verschiedenen Grunderkrankungen zusammenhängen.23
Diese Symptome können von einem Husten, mitunter mit Hämoptyse, begleitet werden. Bei manchen Patienten kommt es sogar zu Heiserkeit und bei fortschreitender PAH zu Zyanose und Ödemen. Die fortgesetzte Belastung des Herzens kann zum Anschwellen des Gesichts, der Knöchel, des Bauchs und der Füße infolge von Wassereinlagerungen führen.1 Zu oft werden die Patienten erst dann beim Arzt vorstellig, wenn sie ihre Alltagsaktivitäten nicht mehr bewältigen können. Zu dem Zeitpunkt kann die Krankheit schon sehr weit fortgeschritten sein.
Typische Symptome der PAH1,23
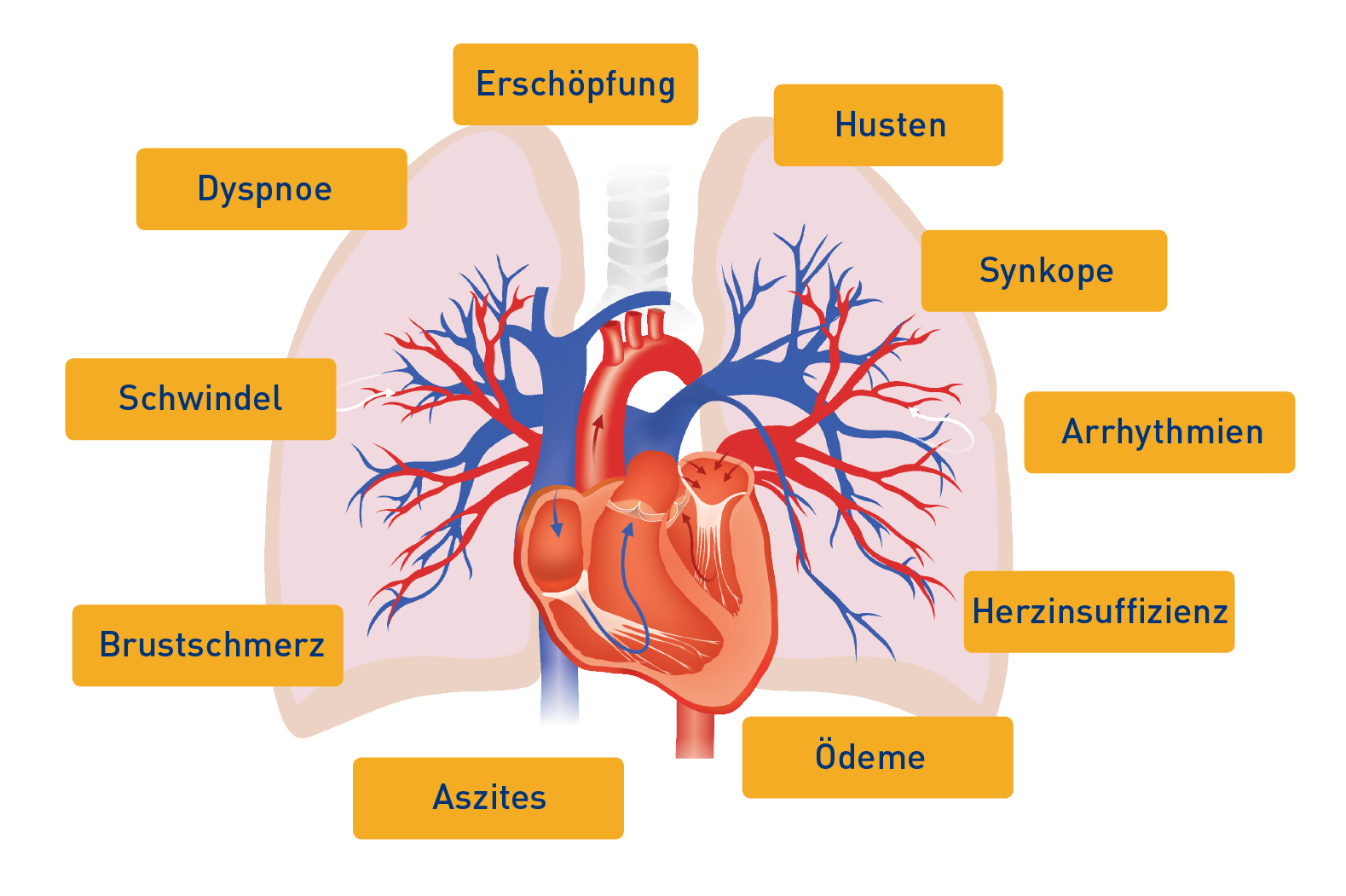
PAH: pulmonal arterielle Hypertonie
VIELLEICHT AUCH INTERESSANT FÜR SIE
In klinischen Leitlinien ist die diagnostische Vorgehensweise festgelegt, damit Patienten mit PAH-Verdacht so schnell wie möglich überwiesen und behandelt werden können.
Moderne Therapien können die Symptome der Patienten deutlich verbessern und die klinische Progression verlangsamen.
Referenzen
[1]: Galiè N et al. Eur Heart J 2016; 37:67–119.
[2]: Lau E et al. Nat Rev Cardiol 2017; 14:603–614.
[3]: Ma L, Chung WK. J Pathol 2017; 241:273–280.
[4]: Montani D et al. Eur Respir Rev 2013; 22:244–250.
[5]: Prins KW, Thenappan T. Cardiol Clin 2016; 34:363v374.
[6]: Thakkar V, Lau EMT. Best Pract Res Clin Rheumatol 2016; 30:22–38.
[7]: Kiely DG et al. Eur Heart J 2019; 21:K9–20.
[8]: Teng R, Wu T. J Formos Med Assoc 2013; 112:177–184.
[9]: Badesch DB et al. Chest 2010; 137:376–387.
[10]: D’Alonzo GE et al. Ann Intern Med 1991; 115:343–349.
[11]: Hoeper MM et al. Int J Cardiol 2016; 203:612–613.
[12]: Barst R et al. Chest 2013; 144:160–168.
[13]: Montani D et al. Orphanet J Rare Dis 2013; 8:97.
[14]: Hoeper MM, Gibbs JSR. Eur Respir Rev 2014; 23:450–457.
[15]: Health and Social Care Information Centre. National Audit of Pulmonary Hypertension, 2013. Available at: files.digital.nhs.uk/publicationimport/pub13xxx/pub13318/nati-pulm-hype-audi-2013-rep.pdf (last accessed May 2020).
[16]: Rhee RL et al. Am J Respir Crit Care 2015; 192:1111–1117.
[17]: Kolstad KD et al. Chest 2018; 154:862–871.
[18]: McGoon MD, Miller DP. Eur Respir Rev 2012; 21:8–18.
[19]: Galiè N et al. Eur Heart J 2010; 31:2080–2086.
[20]: Vonk Noordegraaf A et al. J Am Coll Cardiol 2013; 62:D22–33.
[21]: Jonigk D et al. Am J Pathol 2011; 179:167–179.
[22]: Gaine S. JAMA 2000; 284:3160–3168.
[23]: Humbert M et al. Eur Respir Rev 2012; 21:306–312.